一般の方へ―臨床研究とは―
ページ内目次
臨床研究とは
臨床研究とは、病気の原因や病態、診断や予防方法、新たな治療方法や治療薬、医療機器の開発など患者さんの生活の質(QOL)の向上や健康の増進を目的に、人に対して行なう医学研究です。
当院で行われる臨床研究は「ヘルシンキ宣言」や、「人を対象とする医学系研究に関する倫理指針」などを遵守し、研究に参加される方の人権に配慮した上で実施しています。
当院で行われる臨床研究は「ヘルシンキ宣言」や、「人を対象とする医学系研究に関する倫理指針」などを遵守し、研究に参加される方の人権に配慮した上で実施しています。
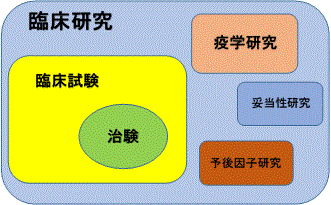
臨床研究概要図
- 臨床研究 : 人を対象として行なわれる医学研究
- 臨床試験 : 薬剤・治療法・予防法などの安全性と有効性を評価することを目的とした研究
- 治験 : 臨床試験のうち、新しい薬や医療機器の製造販売の承認を国に得るために行なわれる試験
- 疫学研究 : 疾病の成因を探り、疾病の予防法や治療法の有効性を評価することを目的とした研究
- 妥当性研究 : 研究のための検査や調査が適格に行われているかを評価することを目的とした研究
- 予後因子研究 : 治療後の病状(予後)に影響を及ぼす因子を調べ、予後の予測をすることを目的とした研究
新しい薬ができるまで
1. 「新薬のたまご」の発見
世界中の医師や科学者が病気に効く物質を見つける為に、日々研究をしています。こうした研究の中から「新薬のたまご」が見つかります。
2. 動物による基礎試験(「新薬のたまご」から「新薬の候補」へ)
まず、「新薬のたまご」は、ねずみや、犬、猿などの動物に使って、どんな作用があるのか、どんな副作用があるのかが調べられます。この試験で病気にたいして効果が期待でき、大きな副作用がないとされた「新薬のたまごは」は「新薬の候補」となります。
3. 人への使用(治験)
「新薬の候補」が、「新薬」として多くの患者さまに使われるようになる為には、どうしても、人に使って有効性や安全性を調べなければなりません。健康な人や、患者さまに「新薬の候補」を使っていただいて、その効果や、副作用を調べることを治験といいます。
4. 「新薬の候補」から「新薬の誕生」
多くの患者さまの協力によって得られた治験の結果は、国(厚生労働省)による審査を受けます、そこで「薬」として承認されたものがはじめて、病院や医院で患者さまに使われるようになります。

5. その後の調査(製造販売後調査)
病院や医院で「薬」がさらに多くの患者さまに使われるようになった後でも、薬は、効果や副作用について引き続き調べられています。そうすることで「薬」はより良い「薬」になることができます。
治験とは?
前に述べたように新しい薬が、病院や医院で使われるようになるまでには、動物実験で主な効果や副作用を調べた後に、新しい薬を人に投与してその効果や副作用について調べるため試験を行って、国(厚生労働省)によって薬としての承認を得る必要があります。この試験のことを「治験」と呼んでいます。
1. 第I 相試験
動物実験で副作用が無く安全で、有効な作用のあることが分かった「新薬の候補」は、健康な成人の方に、少しの量から使い、体の中でどのように変化し、排泄されるか。また、基礎試験での効果が人でも現れるか、副作用はどうなのかが、大変慎重に調べられます。(岡崎市民病院ではI 相試験は行っておりません)
2. 第II 相試験
第I 相試験で重い副作用が無く安全で、効果が確認された「新薬の候補」は、少数の患者さん(数十人)に使われます。本当に効果があるのか、副作用はどうなのかが、ここでも大変慎重に調べられます。
3. 第III 相試験
第II 相試験で重い副作用が無く安全で、効果が確認された「新薬の候補」は、今度はもう少し多くの患者さん(百人から数百人)に使用されます。ここでも、本当に効果があるのか、副作用はどうなのかが、大変慎重に調べられます。
これまでのI 相、II 相、III 相試験のことを治験と言います。
これまでのI 相、II 相、III 相試験のことを治験と言います。
こうして、健康な方や、患者さんの協力によって得られた、治験の結果(新しい薬の有効性や副作用)をもとに、国(厚生労働省)は薬として、病院や医院で使うことができるかどうかを審査し、承認されたものが「薬」として多くの患者さんに使われるようになります。
治験を行なうためのルール

治験の為に、最も優先しなければならないことは、患者さまの「人権」と「安全」を守ることです。直接患者さまの命に関わる「薬」の効果や副作用を調べるのですから「人権」と「安全」を守る為の大変厳しいルールがあります。
1. 医薬品の臨床試験の実施に関する基準
治験は、国が定めた「医薬品の臨床試験の実施に関する基準」(GCP)というルールを守って行われます。このルールには、治験に協力して下さる患者さまの人権や安全を守るための事項と治験で正しいデータを集めるために必要な事項が定められています。
2. 治験審査委員会
当院で行われる治験は、全て「岡崎市民病院治験審査委員会」で審査が行われ、そこで治験の実施継続が審査され、承認をされる必要があります。
「岡崎市民病院治験審査委員会」は病院長か設置し、病院長の任命を受けた医師、薬剤師、看護師、事務などの病院職員と、院長や病院とは関係のない、大学の先生や、福祉関係の仕事をしてみえる外部の委員の方で構成されています。
外部の方の参加によって、委員会において被験者様の側に立った、公正な審査がされることが期待されています。
「岡崎市民病院治験審査委員会」は病院長か設置し、病院長の任命を受けた医師、薬剤師、看護師、事務などの病院職員と、院長や病院とは関係のない、大学の先生や、福祉関係の仕事をしてみえる外部の委員の方で構成されています。
外部の方の参加によって、委員会において被験者様の側に立った、公正な審査がされることが期待されています。
3. 臨床研究コーディネーター
治験事務室には「治験コーディネーター」(CRC)と呼ばれる、薬剤師や看護師がいます。
CRCは治験に参加していただける患者さまの来院の再には患者さまに付き添って、診察や検査がスムーズに行なえるようにします。また、治験に参加していただいている患者さまと電話などで連絡を取ることで、患者さまが安心して治験に参加できるようにしています。
CRCは治験に参加していただける患者さまの来院の再には患者さまに付き添って、診察や検査がスムーズに行なえるようにします。また、治験に参加していただいている患者さまと電話などで連絡を取ることで、患者さまが安心して治験に参加できるようにしています。
